
Segunda parte de la ponencia Seguimiento y recuperación de las poblaciones de conejo europeo (Oryctolagus cuniculus cuniculus) en Mallorca (Illes Balears) (2016-2019), de las Jornadas sobre Investigación y gestión dentro del ámbito cinegético del Consell de Mallorca, y publicado en la Monográfica nº 28, Recerca i gestió dins l’àmbit cinegètic, de la Societat d’Història Natural de les Balears.
Material y métodos
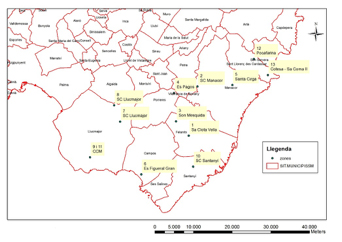
El estudio de las poblaciones silvestres se realizó en diferentes localidades de Mallorca (Fig. 7). Con la intención de evitar la introducción de nuevas variantes genéticas, distintas a las existentes y procedentes de fuera de Mallorca, se seleccionaron un conjunto de poblaciones candidatas de la isla, que presentaran densidades adecuadas para ser donadoras y que cumplieran con los requisitos para hacer las translocaciones requeridas en el proyecto.
Los ejemplares fueron capturados vivos, gracias a la participación de cazadores con hurones, volviéndose a liberar en la zona de captura durante la misma jornada. Las muestras obtenidas fueron de dos tipos: sangre extraída mediante punción auricular, y muestra de cartílago de oreja (aprox. 2 x 2 mm) extraído con sacabocados y conservado en etanol absoluto (ETHA-90p-1K0).
Estas poblaciones potencialmente donadoras, se analizaron genéticamente usando un set de marcadores microsatélites desarrollados por el CIBIO-UP (Portugal) y que tienen una gran capacidad para identificar la estructura genética de las poblaciones de conejo (Alves et al., 2015).
El análisis de las muestras de tejido se realizó en el CIBIO-Inbio (https://cibio.up.pt) siguiendo un protocolo equivalente al usado por Alves et al. (2015), pero basado en 70 microsatélites distribuidos a lo largo del genoma del conejo.
Como muestras de referencia se utilizaron individuos de diferentes poblaciones silvestres (Fig. 8) dentro del rango de subespecies de O. c. algirus (n=64), O. c. cuniculus silvestre de Iberia (n=59), O. c. c. cuniculus silvestre de Francia (n=44), así como conejos domésticos (n=133) pertenecientes a 16 razas (Alves et al., 2015). La extracción de ADN de conejos silvestres y domésticos y los procedimientos de PCR se describen en Alves et al. (2015).
Aplicamos el procedimiento de agrupamiento bayesiano implementado en STRUCTURE, versión 2.3.3 (Pritchard et al., 2000), para un conjunto de datos compuesto por todos los conejos silvestres, domésticos y conejos de Mallorca. La estructura genética fue investigada usando enfoques distintos. El análisis se realizó utilizando el modelo de mezcla y otro sin mezcla para poder valorar tanto la diferenciación como las similitudes de las poblaciones de Mallorca con las poblaciones de referencia. Como el conejo de Mallorca se considera una especie introducida, se valoró la similitud de las poblaciones de estudio con las poblaciones de referencia, pero por otro lado se valoró si la estructura genética de las poblaciones de estudio presentaban una estructura genética independiente o no. Partiendo de ese criterio, aquellas con menor influencia externa y pertenecientes al genotipo mallorquín, se seleccionaron las poblaciones que podrían ser las más adecuadas como poblaciones donadoras.

Siguiendo la metodología empleada en diferentes estudios realizados por miembros del equipo (ej. Rouco, 2008; Ferreira et al., 2014; Rouco et al., 2011) se construyeron tres núcleos de cría de alta densidad, dos de ellos con una superficie de 2500 m2 y nueve vivares (madrigueras artificiales o majanos) en el interior, y otro núcleo de 1075 m2 con cinco vivares de idénticas características (Figs. 9 y 10). Los núcleos se construyeron en el Centre Cinegètic de Mallorca (CCM) siguiendo el modelo disponible en la página web del Consell Insular de Mallorca (https://seu.conselldemallorca.net/ca/fitxa?key=25223, Documento CE12).


A finales del mes de septiembre de 2016 se introdujeron los conejos de las localidades seleccionadas en los vivares de los núcleos de cría. En cada uno de los vivares se introdujeron una media de tres o cuatro hembras y dos machos, previamente identificados mediante crotales numerados (Chevillot, marca Quick). Cada vivar posee un cercado perimetral de malla con 1m de altura y enterrado en el suelo 0,5m (Fig. 10), en el que se dispone una jaula-trampa que constituye el lugar de entrada y salida habitual del vivar. Las jaulas-trampa están dotadas de un sistema que permite la captura de los conejos siempre que es necesario.
La alimentación se realizó a base de pienso (Cuniunic, NANTA, de alta seguridad digestiva y con una relación proteína-fibra óptima), alfalfa fresca y seca según disponibilidad, con suministro de agua constante mediante bebederos de coto. Durante los primeros días la cantidad de pienso ofrecida se midió, aumentando progresivamente la cantidad desde aproximadamente 20g por individuo el primer día de adaptación hasta alcanzar los 60g por individuo el séptimo día, y finalmente alimentación ad libitum, siguiendo las recomendaciones de Calvete et al. (2005). Una vez adaptados, el consumo medio diario de pienso compuesto por animal y día oscila entre los 46 y los 68 g, con una media de 56,6g administrado ad libitum o libre disposición (Arenas, 2002).
Para la realización de las repoblaciones hay que tener en cuenta que el periodo reproductivo (típicamente entre noviembre y junio) está influenciado por las condiciones locales de temperatura e intensidad de lluvias (Gonçalves et al., 2002; Soriguer y Rogers, 1981; Villafuerte et al., 1997). En el caso de las Illes Balears la sequía estival requiere de la presencia de un suministro de agua constante, evitando para las translocaciones zonas de inundación y períodos de lluvias torrenciales, por lo que la introducción de los ejemplares se realizó entre los meses de julio a octubre (años 2017 y 2018), siendo durante este último mes menos frecuente la introducción de ejemplares, con el fin de favorecer su adaptación antes del inicio de la época reproductora (Moreno et al., 2004).
Según Wood (1980) los juveniles salen de las madrigueras con unas tres semanas de vida y con un peso medio de 150-200g, pero para las translocaciones se seleccionaron conejos mayores de tres meses con la finalidad de aumentar sus expectativas de supervivencia, debido a las altas tasas de depredación que sufren los gazapos, de hasta el 80% en los primeros tres meses de vida (Myers et al., 1994).
Para la introducción de los ejemplares se asesoró a los colaboradores en la construcción y distribución de los vivares en cada coto, según el modelo anteriormente expuesto e idéntica alimentación que la ofrecida en los núcleos de origen durante la primera semana. Teniendo en cuenta que el área de campeo tiene una superficie media de unas tres hectáreas (Kolb, 1990; Parer y Libke, 1985; Villafuerte, 1994) y en las cuales deben existir zonas de refugio, alimentación y de cría. Todo ello con la finalidad de optimizar la adaptación y supervivencia del mayor número de individuos posible.

En cuanto al control sanitario de los ejemplares y la determinación de la causa de baja de los individuos muertos en los núcleos de cría de alta densidad, se recogieron muestras de hígado fresco que fueron congeladas (-18ºC) y analizadas mediante PCR frente a la nueva variante del virus de la RHD en el Laboratorio Central de Veterinaria de Algete (Madrid).

La incidencia de mixomatosis fue detectada de manera visual, y especialmente en el período habitual de mayor aparición de la enfermedad. Los brotes de esta enfermedad son estacionales, siendo más frecuentes durante los meses templados (Alda et al., 2008), puesto que es cuando existe mayor cantidad de animales susceptibles (Calvete et al. 2002). La detección de sarna sarcóptica se basó en los signos clínicos (presencia de piel costrosa o escamosa) y la evidencia de ácaros o sus estadios de desarrollo en raspados de piel del hospedador (Kettle, 1995), seguida de confirmación de los casos por microscopía directa. También se realizó un control de la presencia de depredadores con la instalación de cámaras de fototrampeo (BLK-10, con LED infrarrojo invisible) y seguimiento de los ejemplares gracias a las mismas.

La tasa de supervivencia de los conejos introducidos en los núcleos de cría fue calculada de manera cuantitativa, mediante la prospección periódica (cada 2 o 3 días) en busca de los individuos fallecidos en el área. La determinación de los factores de mortalidad se realizó mediante inspección, y en su caso disección, del cadáver. Se consideró muerte por depredación cuando los restos tenían evidentes signos de depredación (plumas, mechones de pelo y restos de huesos largos), o mamíferos (ej. marcas claras de dentición, excrementos, etc.). Las muertes por enfermedad se determinaron analíticamente cuando fue posible, pero también por exámenes post mortem buscando las lesiones típicas, como las lesiones cutáneas de la mixomatosis, las hemorragias petequiales y escasa coagulación de la RHD, o las mencionadas descamaciones de la piel producidas por la sarna sarcóptica.
El seguimiento de los ejemplares en las áreas de repoblación se realizó mediante conteo de indicios de la presencia de la especie (excrementos, letrinas, escarbaduras y madrigueras) recorriendo entre tres y cinco kilómetros, obviamente sin incluir los núcleos de cría ni las zonas más cercanas a ellos, de forma que se obtuviera un índice relativo de abundancia de conejos con el que valorar la evolución de la población de conejo a lo largo del tiempo (ej. Villafuerte et al., 1998). Igualmente se realizaron transectos en vehículo (ej. Moreno et al., 2007), debiendo repetirse ambas tareas en el futuro para conseguir resultados en cuanto a la evolución de las poblaciones objeto de translocación.
María MUÑOZ1, Antoni BARCELÓ1, Catalina RAYÓ1, Margarita BERNAT1, Joana M. BARCELÓ 1, Vanesa CASTILLO1, Francisca CASTRO2,3, Patricia H. VAQUERIZAS3,4, José Antonio BLANCO-AGUIAR5,6, Fernando APARICIO3,4, Bartomeu SEGUÍ1 , Rafael VILLAFUERTE3,4
- Servei de Caça del Departament de Desenvolupament Local del Consell de Mallorca. Llar de la Joventut. General Riera, 111, 07010 Palma (Mallorca) Illes Balears.
- Departamento de Didáctica de las Ciencias Sociales y Experimentales. Facultad de Ciencias de la Educación. Universidad de Córdoba. Avda. San Alberto Magno s/n, 14071 Córdoba.
- Departamento de Zoología, Universidad de Córdoba. Campus de Rabanales, 14071 Córdoba.
- Instituto de Estudios Sociales Avanzados (IESA-CSIC). Campo Santo de los Mártires 7, 14004 Córdoba.
- Instituto de Investigación en Recursos Cinegéticos (IREC). Ronda de Toledo s/n, 13005 Ciudad Real.
- CIBIO/InBIO, Centro de Investigação em Biodiversidade e Recursos Genéticos, Universidade do Porto, Vairao, Portugal.
Autor de correspondencia:
María del Carmen Muñoz Muñoz
Servei de Caça del Consell Insular de Mallorca, Departament de Desenvolupament Local
General Riera, 111, 07010 Palma de Mallorca, España.
Tel: +34971219846
Email: [email protected]




















